根据国家药监局官网信息,截至10月1日,九月共计有5款抗癌新药和新适应症在国内获批上市。这些新药的获批为白血病、胃癌、非小细胞肺癌等患者带来新的治疗选择。
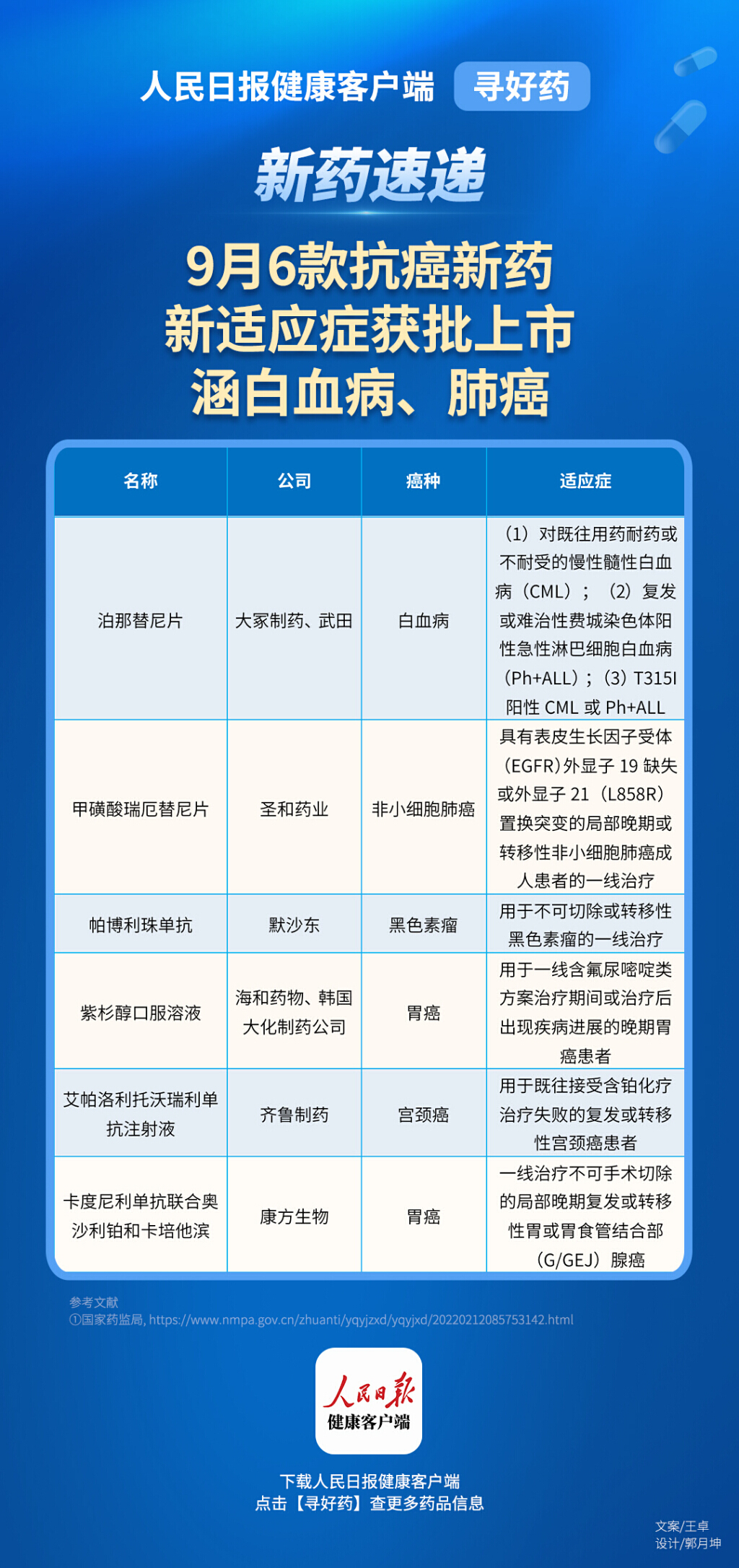
9月9日,由大冢制药和武田共同开发的第三代Bcr-Abl激酶抑制剂泊那替尼片获批。根据国家药监局药品审评中心优先审评公示,本次获批的适应症包括:对既往用药耐药或不耐受的慢性髓性白血病;复发或难治性费城染色体阳性急性淋巴细胞白血病(Ph+ALL);T315I阳性CML或Ph+ALL。此前,该药品已于2016年获得美国FDA的全面批准上市。
9月9日,圣和药业1类创新药第三代EGFR-TKI甲磺酸瑞厄替尼片新适应症获批,用于具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌成人患者的一线治疗。这是甲磺酸瑞厄替尼片继今年6月获批二线适应症后的第二项适应症。
9月14日,默沙东的抗PD-1单抗帕博利珠单抗在获批新适应证,用于不可切除或转移性黑色素瘤的一线治疗。帕博利珠单抗于2018年在中国获批首个适应证,为用于晚期黑色素瘤二线治疗。本次获批意味着其针对黑色素瘤患者的治疗范围进一步扩大至一线治疗。
9月25日,海和药物和韩国大化制药公司共同宣布,双方合作开发的紫杉醇口服溶液获得国家药监局批准上市,用于一线含氟尿嘧啶类方案治疗期间或治疗后出现疾病进展的晚期胃癌患者的治疗。
此前国内上市的剂型均为注射剂。该药品在国内的临床研究,由同济大学附属东方医院李进教授团队和南京天印山医院秦叔逵教授团队作为主要研究者,证实紫杉醇口服溶液对经一线治疗后的不可手术切除、复发或转移性晚期胃癌疗效明确、安全可控。
9 月 30 日,齐鲁制药有限公司申报的艾帕洛利托沃瑞利单抗注射液(齐倍安)附条件批准上市,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。
该药品是齐鲁制药基于MabPair技术平台研发的1类新药,可以在体内维持正常PD-1抗体暴露量的同时,降低CTLA-4抗体的暴露量,有望成为毒性更低、耐受性更佳的双免疫疗法。目前,齐鲁制药还开展了多项艾帕洛利托沃瑞利单抗在其他癌种中的临床研究,包括肝癌、鼻咽癌和非小细胞肺癌等。
9月30日,卡度尼利单抗联合奥沙利铂和卡培他滨方案获批,用于一线治疗不可手术切除的局部晚期复发或转移性胃或胃食管结合部腺癌。
卡度尼利单抗是PD-1/CTLA-4双特异性抗体,能够同时阻断PD-1和CTLA-4两条免疫抑制通路。该方案可降低PD-1抑制剂联合CTLA-4抑制剂可能带来的毒性风险。
(责编:荆雪涛)

