èç½è´¨ææå·¥ç¨æ¯èç½è´¨å·¥ç¨çä¸ä¸ªæ°å ´é¢åï¼éè¿æ¹åèç½è´¨çåå¦ææç»æï¼å¯ä»¥æ¾èæåå ¶ç¨³å®æ§ãè°èå¨æç»æ并å¢å¼ºå¤ä»·æåºçåè½ãç¶èï¼ä¼ ç»èç½è´¨åéäºèªç¶è½¬å½ç¿»è¯æºå¶ï¼éå¸¸å ·æ线åç主é¾ææç»æï¼è¿å¨ä¸å®ç¨åº¦ä¸éå¶äºå ¶åè½ååºç¨ãè¿å¹´æ¥ï¼ç§å¦å®¶ä»¬æåºï¼é¤äºçº¿åç»æå¤ï¼èç½è´¨è¿å¯ä»¥åç°æ´ä¸ºå¤æç主é¾ææå½¢å¼ï¼å¸¦æ¥æ´å¤çåè½ä¼å¿ã
è¿æï¼å京大å¦åå¦ä¸ååå·¥ç¨å¦é¢å¼ æ彬ææ课é¢ç»å¨åç»æåèç½è´¨ææ设计ååææ¹é¢åå¾äºéè¦è¿å±ãä»ä»¬å°è°ç»æåï¼SpyTag/SpyCatcherï¼æå为SpyTagãBDTagåSpyStaplerï¼éè¿éæ°ç¼è¾ä¸ç»åä¹é´çè¿æ¥å ³ç³»å¼å ¥ç¼ ç»å ³ç³»ï¼è®¾è®¡å¹¶åæäºç´¢çèç½ï¼Catenaneï¼ãç¯ç¶èç½ï¼Cyclicï¼ãå¥ç´¢èç½ï¼Lassoï¼ä»¥ååè½®ç·èç½ï¼Rotaxaneï¼ï¼å¹¶éè¿çªåå ¶ä¸ä¸ä¸ªæ´»æ§ä½ç¹ï¼åºé¤åæ¬çå¼è½é®è¿æ¥ï¼å¾å°äºçº¿åèç½ï¼Linearï¼ã纽ç»èç½ï¼Knotï¼åå¦ä¸ç§åè½®ç·èç½ï¼Rotaxane(DA)ï¼ï¼å¾1ã2ï¼ï¼å®ç°äºåç»æåèç½è´¨ææäºåçç³»ç»æ建ã
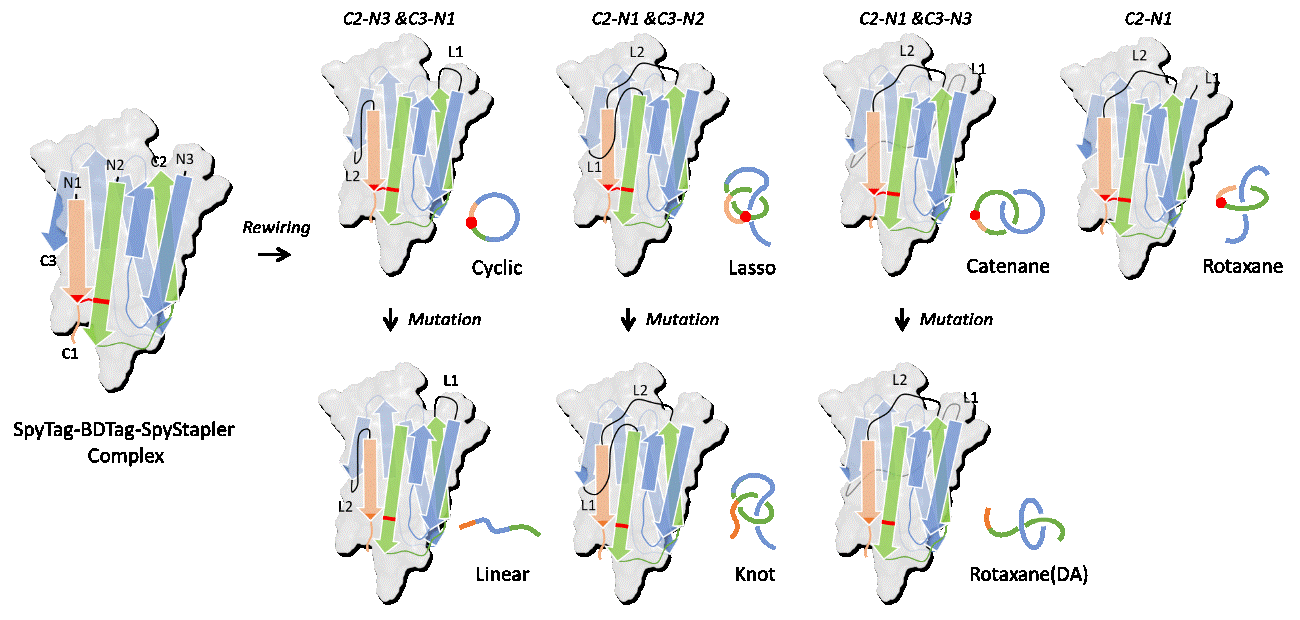
å¾1. ä¸ç§åç»æåææäºåï¼çº¿åãç¯ç¶ã纽ç»ãå¥ç´¢ãç´¢ç以å两ç§åè½®ç·ï¼ç设计
为ä¼åè¿ä¸ç³»åææèç½è´¨çåæï¼ä»ä»¬è®¾è®¡äºä¸¤ç»ä¸åè¿æ¥é¾é¿åº¦çæ ·åè¿è¡èå åæã为æ大åææç»æ对èç½è´¨æ象çéå¶ä½ç¨ï¼åå°ææ§è¿æ¥é¾å¯¹èç½è´¨çåå¦ç¨³å®æ§çå½±åï¼ä»ä»¬è®¾è®¡äºå ·ææçè¿æ¥é¾çä¸ç³»åå¯¹ç §æ ·åï¼ç§°ä¸ºs-seriesï¼å ¶é¢æµç»æä»ç¶è½ææä¿æç®æ çç¸å¯¹ç©ºé´å ³ç³»ãç¶èï¼ç±äºBDTagåSpyTagä¹é´è¿æ¥é¾è¾çï¼ååå éç»æ æ³ææè¿è¡ï¼å¾åäºåçç»æå交æ¢ï¼é¨åæ ·åå½¢æäºäºèä½ï¼å¾2Aã2Bï¼ã为ä¼åååºéæ©æ§ï¼ä»ä»¬å设计äºä¸ç³»åé¿é¾å¯¹ç §æ ·åï¼l-seriesï¼ãå®éªç»æ表æï¼é¿é¾æ ·åç主è¦äº§ç©ä¸ºé¢æçåç»æåèç½è´¨ï¼å¾2Cï¼ã

å¾2. A, è¿æ¥é¾çé¿åº¦å¯¹åç»æåææäºååæéæ©æ§çå½±åï¼B, çé¾æ¥é¾æ ·åçåæç»æï¼C, é¿é¾æ¥é¾æ ·åçåæç»æ
ä»ä»¬å¯¹åæéæ©æ§è¾é«çé¿é¾æ ·åè¿è¡äºå®éªè¡¨å¾ãå ç§æ ·åçåäºè²è°±åææ¾ç¤ºï¼å¨230nmå¤åè§å¯å°Î²-turnç»æçç¹å¾å³°ï¼è¡¨æç»æåçæåæªç ´åèç½è´¨çæ´ä½äºçº§ç»æï¼å¾3Aï¼ãäºç»´æ ¸ç£å ±æ¯åææ¾ç¤ºï¼æ ·å表ç°åºä¸è°ç»æå类似ç交åå³°ä¿¡å·ï¼å«å¼è½é®çæ ·åå¨6ppmå¤æç¹å¾å³°ï¼å¾3Bï¼ã差示æ«æéçæ³æµè¯ç»æ表æï¼å«å¼è½é®çèç½è´¨æ¯çªåä½æ´å 稳å®ï¼çç¹æ¯ä¸å«å¼è½é®ççªåä½é«åº30°C以ä¸ï¼å¾3Cï¼ï¼è¡¨æå¼è½é®å¨ç»´æèç½è´¨ç¨³å®æ§æ¹é¢åæ¥äºéè¦ä½ç¨ã
为äºç»è´æ示èç½è´¨ææçææå ³ç³»ï¼è¯¾é¢ç»éè¿å®éªè¡¨å¾åååå¨åå¦æ¨¡æç 究äºææ对èç½è´¨ç¨³å®æ§åæå çå½±åï¼å¾3ï¼ãç 究ç»æ表æï¼å°½ç®¡è¿äºèç½è´¨å¨å¸¸æ¸©å¸¸åä¸å±ç°åºç¸ä¼¼ç稳å®æ§åæå ç»æï¼ä½å¨é«æ¸©ä¸ï¼å®ä»¬çæå å¨åå¦ç¹æ§å´ææä¸åãå¨ååå¨åå¦æ¨¡æä¸ï¼å«å¼è½é®çèç½è´¨å±ç¤ºåºæ´å¥½ç稳å®æ§ï¼èçªåä½ä¸çæ°¨åºé ¸æ®åºå¾åäºéæ¸äºç¸è¿ç¦»å¹¶å¤±å»å é¨æ¥è§¦ï¼å¾3Dï¼ãæ¤å¤ï¼å¨é«æ¸©ä¸ï¼ç´¢çèç½ç两个ç¯åç°åºææ¾çè´ç¸å ³è¿å¨ï¼è¡¨æå®ä»¬çè¿å¨æ¯ç¸å¯¹ç¬ç«çï¼å¾3Eï¼ãæ趣çæ¯ï¼å¨è§£æå è¿ç¨ä¸ï¼ç´¢çèç½è¿è¡¨ç°åºå¾å¤çäºçº§ç»ææ¶å¤±åéå½¢æï¼è¿ä¸å ¶å®è§ä¸å ·ææ´å¥½ççåå¼¹æ§æ¯ä¸è´çï¼å¾3Fï¼ã
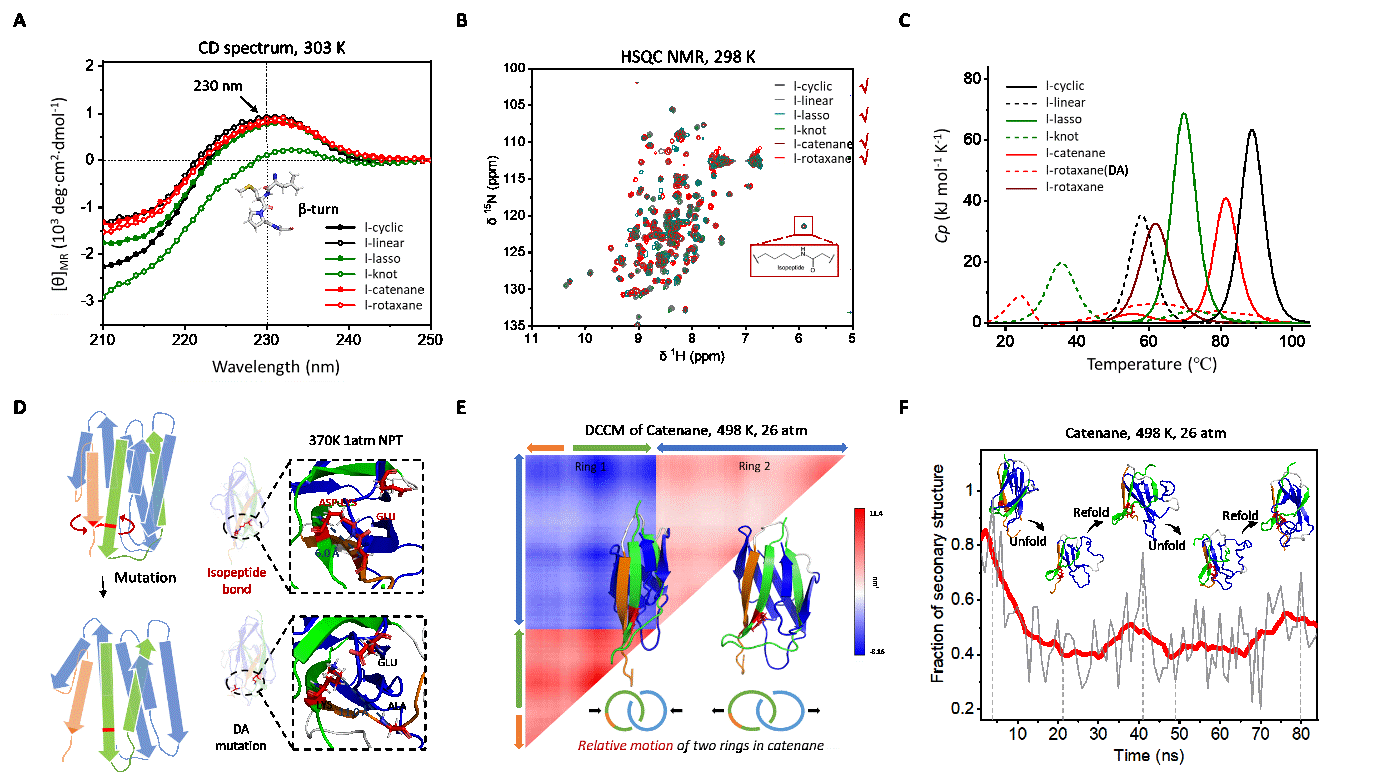
å¾3. A, é¿é¾æ ·åçåäºè²è°±è¡¨å¾ç»æï¼B, é¿é¾æ ·åçäºç»´æ ¸ç£è¡¨å¾ç»æï¼C, é¿é¾æ ·åç差示æ«æéçæ³è¡¨å¾ç»æï¼D, ä¸å«å¼è½é®ççªåä½ä¸æ°¨åºé ¸éæ¥è¿ç¦»ï¼E, ç´¢çèç½ç两个ç¯åç°åºææ¾çè´ç¸å ³è¿å¨ï¼F, ç´¢çèç½ç解æå 模æä¸è¿è§å¯å°äºç¬æ¶çäºçº§ç»ææ¢å¤ç°è±¡
综ä¸æè¿°ï¼ä½è éè¿è°ç»æåäºçº§ç»æåºå çéæ°æ¥çº¿åçªç¹çªåï¼è®¾è®¡å¹¶åæäºä¸ç§å ·æç¬ç¹ææç»æçåç»æåèç½è´¨ï¼å æ¬çº¿åãç¯ç¶ã纽ç»ãå¥ç´¢ãåè½®ç·åç´¢çç»æï¼ãå®éªè¡¨å¾åååå¨åå¦æ¨¡æç»æ表æï¼è¿äºèç½è´¨å¨å¸¸æ¸©å¸¸åä¸è¡¨ç°åºç±»ä¼¼çæ象ï¼ä½ç°åºçæ°´æ ¸å¿çä¿å®æ§ï¼èå¼è½é®çå½¢æåæºæ¢°äºéç»æåæ¾èå½±åäºèç½è´¨ç稳å®æ§åæå è¡ä¸ºã
该ç 究è¿æå¨çº¿å表äºç¾å½å½å®¶ç§å¦é¢é¢åPNASï¼å京大å¦åå¦ä¸ååå·¥ç¨å¦é¢å士çæ²å¿å®ä¸ºè¯¥è®ºæ第ä¸ä½è ãå京大å¦åå¦ä¸ååå·¥ç¨å¦é¢å士å许è¿æ°ãå士çèå¯é¸ãåæºç 究åä¹ä¸ºæ¬å·¥ä½ä½åºäºè´¡ç®ãå¼ æ彬为é讯ä½è ã该工ä½å¾å°å½å®¶èªç¶ç§å¦åºéå§ãå½å®¶éç¹ç å计åãå京ååç§å¦å½å®¶ç 究ä¸å¿çæ¯æã

